|
| chemiaprusy - substancje-wstep
|
|
|
|
Tematyka strony:
Składniki powietrza.
Zanieczyszczenia powietrza.
Dziura ozonowa, efekt cieplarniany.
Kwaśne deszcze.
Mieszaniny i sposoby ozdziału ich składników.
Przemiana fizyczna i chemiczna.
Właściwości fizyczne i chemiczne substancji.
Temat:Powietrze i jego składniki. Zanieczyszczenia powietrza.
1.Powietrze jest gazem: bezwonnym; bezbarwnym; bez smaku;
ulega sprężeniu, rozprężeniu, skropleniu; nie przewodzi prądu.
2. Skład procentowy powietrza: 78%- azot; -21%- tlen;
- 1%- dwutlenek węgla, argon, wodór, para wodna, zanieczyszczenia.
Dziura ozonowa
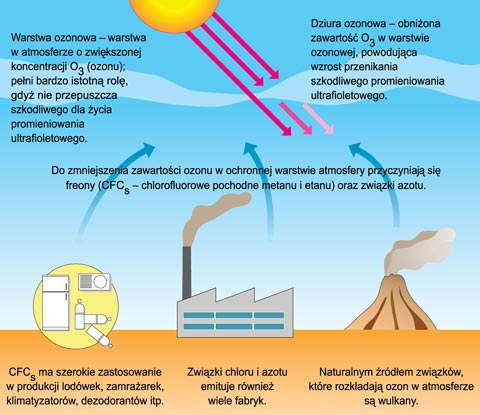
Wiemy, że na wysokości 20 - 26 km w atmosferze utworzona jest warstwa ochronna nazywana
warstwą ozonową. Spełnia ona rolę tarczy zatrzymującej promieniowanie ultrafioletowe,
które dla wielu organizmów jest zabójcze. To między innymi dzięki tej tarczy stał się
możliwy rozwój organizmów żywych na powierzchniach lądów. Gdyby ta tarcza ochronna
nie istniała, życie byłoby możliwe tylko w wodzie, która również chroni przed zabójczym
promieniowaniem, zaś powierzchnia lądów stanowiłaby do dziś zupełną pustynię.
Od początków lat 70-tych XX wieku obserwuje się, szczególnie we wrześniu, zmniejszanie się
zawartości ozonu nad Antarktydą. Za ten stan przypuszcza się są odpowiedzialne substancje
chemiczne o nazwie freony wykorzystywane w areozolach i lodówkach.
Kwaśne deszcze
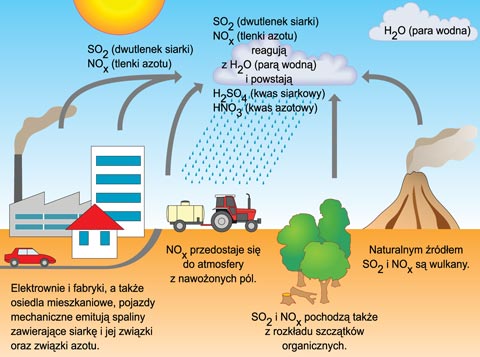
Przyczyną występowania kwaśnych opadów jest reakcja chemiczna, k
tóra zachodzi w atmosferze. W jej wyniku dwutlenek siarki (SO2), tlenki azotu (NOx)
i para wodna (H2O) tworzą kwasy: siarkowy i azotowy. Opadając na ziemię –
nie tylko w postaci deszczów, ale także jako śniegi i mgły – powodują one
zakwaszenie gleb, niszczą faunę i florę, przyspieszają korozję metalowych
konstrukcji urządzeń i budowli.
Na kwaśne opady najbardziej narażone są obszary leżące w sąsiedztwie
źródeł zwiększonej emisji SO2 i NOx. Dotyczy to zwłaszcza rejonów elektrowni
i elektrociepłowni opalanych zasiarczonym paliwem – węglem kamiennym
i brunatnym. Często jednak opady te, niesione wiatrami, trafiają na obszary
odległe od źródeł zanieczyszczeń atmosfery. Dlatego przeciwdziałanie
kwaśnym deszczom stanowi problem międzynarodowy.
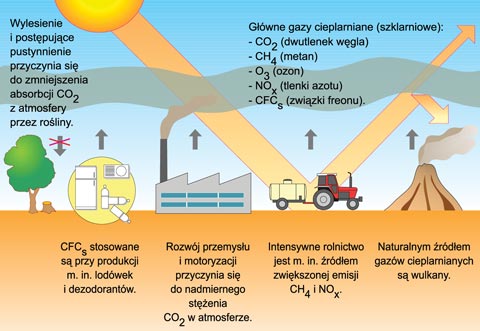
Efekt cieplarniany jest to zjawisko występujące w atmosferze spowodowane
obecnością w powietrzu pary wodnej,
dwutlenku węgla, ozonu , tlenku węgla oraz metanu i występował
zawsze od kiedy w atmosferze Ziemi pojawił sie dwutlenek węgla
i woda. Wymienione substancje posiadają zdolność
pochłaniania (zatrzymywania) w atmosferze ciepła
pochodzącego z nagrzewania Ziemi przez Słońce
oraz własnego ciepła powstającego we jej wnętrzu.
A to oznacza, że ciepło zostaje uwięzione, co daje
efekt podobny do efektu wywołanego przez dach szklarni.
Największy udział w tym efekcie ma para wodna i dwutlenek węgla.
Jeżeli w przyrodzie jest zachowana równowaga wymienionych
gazów to mówimy, że mamy do czynienia z naturalnym efektem cieplarnianym.
W ostatnich dziesięcioleciach w wyniku działalności człowieka ta równowaga
została zachwiana. W atmosferze zanotowano znaczny wzrost zawartości
dwutlenku węgla. Jest to wynikiem;
- spalania dużej ilości paliw (węgiel, benzyna, olej napędowy)
- wycinania drzew, które pochłaniają dwutlenek wegla w procesie fotosyntezy
Przypuszcza się, że jest to główny czynnik wzrostu średniej temperatury
na Ziemi. Skutki mogą okazać się tragiczne, szczególnie dla tych miejsc,
które są położone blisko oceanów i mórz. W wyniku topnienia lodów
ulegną zalaniu znaczne obszary kontynentów a klimat wielu miejsc
ulegnie zmianie. Przypuszcza się, że w Polsce będziemy mieli klimat podobny
do tego, który występuje dziś na południowych Morawach.
Temat: Sposoby rozdzielania składników mieszanin.
|

Rys.7 Filtracja - oddzielenie drobin
kredy od wody
|
Filtracja
Przykładem filtracji jest rozdzielenie mieszaniny zawierającej drobiny kredy zawieszone wodzie (rys. 7). W celu rozdzielenia takiej mieszany wystarczy przepuścić taką mieszaninę przez warstwę filtrującą, którą może być zwykła bibuła. Na filtrze pozostaje osad a rozpuszczalnik przenika przez filtr i oczyszczona od osadu spływa do naczynia.
W celu przeprowadzenia filtracji sączek z pofałdowanej bibuły filtracyjnej układamy w lejku odpowiedniej wielkości, dociskamy do ścianek i zwilżamy wodą destylowaną. Ciecz do filtracji powoli (najlepiej po bagietce) wlewamy do lejka. Filtr napełniamy do poziomu ok. 1 cm poniżej jego krawędzi. Następną porcję wlewamy do filtru dopiero wtedy, kiedy poprzednia została już przefiltrowana.
|
|

Rys.8 Odparowanie
|
Odparowanie
Odparowanie ma zastosowanie do mieszanin jednorodnych (rys.8). Przykładem takiej mieszaniny jest solanka (woda + sól). Przepuszczając taką mieszaninę przez filtr nie jesteśmy w stanie jej rozdzielić. Dopiero zastosowanie odparowania pozwala nam rozdzielic ten rodzaj mieszanin. Sam proces polega na ogrzewaniu mieszaniny z której odparowuje woda a w naczyniu pozostaje sól.
Proces odparowania (zatężania) może być przeprowadzony w parownicy lub szkiełku. Przed rozpoczęciem odparowania naczynie napełniamy roztworem co najwyżej do połowy, Następnie ustawicznie mieszając bagietką podgrzewamy naczynie na małym ogniu. Usuwamy palnik po odparowaniu około połowy objętości rozpuszczalnika. Pozostała ilość rozpuszczalnika odparowuje wykorzystując ciepło rozgrzanego naczynia.
|
|

Rys.9 Destylacja
|
Destylacja
Jeżeli będzie nam zależało na odzyskaniu cieczy, wtedy zastosujemy proces, który nazywamy destylacją (rys.9).
Kolba destylacyjna powinna być wypełniona co najwyżej do połowy. Przed rozpoczęciem podgrzewania cieczy w kolbie należy odkręcić dopływ wody do chłodnicy. Oczekiwana temperatura par w kolbie destylacyjnej mierzona jest termometrem laboratoryjnym. Kolbę ogrzewamy początkowo stosunkowo dużym płomieniem, który zmniejszamy w momencie rozpoczecia wrzenia. Aby zapobiec przegrzaniu cieczy, do kolby wrzucamy kawałeczki porcelany.
|
|

Rys.10 Kryształy
|
Krystalizacja
Proces krystalizacji ma zastosowanie do rozdzielenia mieszanin jednorodnych, z których jedna jest cieczą a druga ciałem stałym rozpuszczalnym w wodzie lub innych rozpuszczalnikach. Przykładem takiej substancji może być sól kuchenna, która jak wiemy jest bardzo dobrze rozpuszczalna w wodzie.
Żeby krystalizacja była możliwa, mieszanina (roztwór) musi znajdować sie w stanie przesycenia, co osiągamy poprzez odparowanie i ogrzewanie roztworu. W takim roztworze po schłodzeniu, na dnie naczynia tworzą się kryształy (rys.10).
|
|

Rys.11 Separacja - rozdział dwóch
nie mieszających się cieczy
|
Rozdzielanie mieszaniny, dwóch nierozpuszczalnych wzajemnie cieczy
Przykładem takiej mieszaniny woda zmieszana z olejem. Te dwie substancje zmieszane ze sobą po pewnym czasie rodzielą się, tworząc dwie warstwy. Olej jako lżejszy od wody, utworzy warstwę górną a woda znajdzie się w warstwie dolnej. Wystarczy wtedy zlać olej z nad wody aby uzyskać rozdzielenie tych dwóch substancji. Dokładniejszy rozdział tych substancji uzyskamy spuszczając dolną warstwę przez zawór, jednocześnie obserwując granicę kontaktu tych dwóch warstw. Przebieg tej metody ilustruje rysunek 11.
|
Temat: Mieszaniny substancji.
Mieszanina jednorodna (homogeniczna) - ma jednakowe właściwości w całej rozciągłości, tzn. gołym okiem lub za pomocą lupy czy mikroskopu nie można rozróżnić jej składników. Mieszaniny jednorodne (homogeniczne) noszą nazwę roztworów.
|

Rys.6 Roztwór jednorodny
|
Przykładami mieszanin jednorodnych (homogenicznych) są:
- stopy metali (brąz)
- benzyna (mieszanina węglowodorów)
- solanka (roztwór wodny soli kamiennej)
- cukier w wodzie
- powietrze (mieszanina gazów)
- roztwory wodne soków
- ocet
Szczególnym przykładem mieszaniny jednorodnej, jest roztwór sporządzony przez rozpuszczenie cukru w wodzie. Kryształy cukru rozpuszczone w wodzie rozpadają sie na takie drobiny, które praktycznie stają się niewidoczne dla naszego oka. Efekt taki możemy zaobserwować podczas słodzenia herbaty.
|
W mieszaninie jednorodnej składnik występujący w nadmiarze nosi nazwę rozpuszczalnika a pozostałe składniki substancje rozpuszczone.
Mieszaniny niejednorodne (heterogeniczne)
|

Rys.7 Emulsja
|
Mieszaniny niejednorodne (heterogeniczne) - składają się z części o różnych właściwościach, w których można gołym okiem lub za pomocą lupy czy mikroskopu rozróżnić przynajmniej jeden składnik. Przykładem takiej mieszaniny są:
- opiłki żelaza zmieszane z cukrem,
- piasek z wodą,
- zaprawa murarska (piasek zmieszany z wodą, wapnem i cementem).
Szczególnymi rodzajami mieszanin niejednorodnych są;
|
|

Rys.8 Piana
|
- Emulsje (rys.7). Powstają w wyniku zmieszania dwóch nierozpuszczalnych wzajemnie cieczy, z których jedna jest rozproszona w drugiej. Mleko jest przykładem emulsji. Zewnętrznie wygląda jak czysta substancja, ale pod mikroskopem można dostrzec pojedyńcze kulki tłuszczu,
- Piana (piana z mydła) (rys.8). Składa się z pęcherzyków gazu rozproszonych w cieczy lub ciele stałym,
- Dym. Zawiera drobiny ciał stałych rozproszone w fazie gazowej jaką jest powietrze,
- Mgła. Zawiesina bardzo małych kropel wody lub lodu w powietrzu,
- Szlamy. Osady pochodzenia organicznego lub nieorganicznego powstały na dnie zbiorników wodnych,
Często w celu ustalenia składu próbki, która, jak sądzimy, jest mieszaniną, musimy rozdzielić jej składniki i zidentyfikować poszczególne, zawarte w próbce substancje.
|
Temat: Właściwości fizyczne i chemiczne substancji. Przemiana fizyczna a reakcja chemiczna.
Materia jest częścią wszechświata, występującą pod postacią - gazów, cieczy i ciał stałych o różnych kształtach i wymiarach. Składnikami materii są natomiast substancje, które mają swoją masę i objętość. I właśnie chemia jako nauka zajmuje się substancjami. Pospolite substancje to:
- woda
- cukier
- sól
- żelazo
- itd
Wszystko to możemy zobaczyć w naszym otoczeniu, dotknąć i poddać przeróbce. Czytelnik może podać wiele innych przykładów.
Czym jest substancja?
Takimi substancjami są wcześniej podane przykłady, tj. czysta sól, czysta siarka, czysta woda, czyste żelazo, czysty cukier. Ale w świetle podanej definicji roztwór cukru w wodzie nie jest substancją oraz tak samo woda mineralna kupowana w sklepie nie jest substancją. Innym przykładem może być benzyna, która ma strukturę jednorodną ale jest mieszaniną wielu substancji.
Co nam pozwala identyfikować substancje chemiczne?
Do identyfikacji substancji (materii) chemicy wykorzystują znajomość właściwości substancji, którymi są;.
- właściwości fizyczne
- właściwości chemiczne
Ogólnie pojęcie "właściwość" określa charakterystyczne cechy substancji (materii), które pozwalają identyfikować substancję jak i również wydzielić ją z mieszaniny róznych substancji.
Właściwość fizyczna
Właściwość fizyczna to taka cecha substancji, którą można obserwować i mierzyć bez dokonywania przemiany jednej substancji w drugą
|
Właściwość fizyczna
|
Badanie właściwości substancji
|
|
Właściwością fizyczną jest;
- stan skupienia
- temperatura topnienia
- temperatura wrzenia
- barwa
- rozpuszczalność w wodzie i innych rozpuszczalnikach
- wytrzymałość na uderzenia i zarysowanie
- gęstość
- przewodnictwo elektryczne
- zachowanie sie w polu magnetycznym
- smak
- kowalność
|
W czasie badania właściwości substancji wykorzystujemy metody fizyczne. A niektóre z tych badań są na tyle proste, że możesz je z powodzeniem wykonać w warunkach domowych. Na przykład;
· stan skupienia - badamy wzrokiem, co pozwala odróżnić stan gazowy, ciekły i stały
· rozpuszczalność - wystarczy wrzucić do wody i sprawdzic czy dana substancja w czasie mieszania rozpuszcza się czy nie
· wytrzymałość na uderzenia - sprawdzamy wytrzymałość substancji na uderzenia np. młotkiem. Jeżeli substancja jest krucha uderzona rozpada się na kilka części
· przewodnictwo elektryczne - sprawdzamy budując prosty obwód elektryczny w którym wykorzystamy prostą bateryjkę, odcinki przewodów i żarówkę a badaną próbkę włączamy w obwód. Jeżeli substancja przewodzi prąd elektryczny, żarówka zaświeci się, w przeciwnym przypadku nie zaświeci się.
Badanie innych właściwości substancji wymaga zastosowania aparatury i przyrządów, którymi najczęściej w domu nie dysponujemy.
|
Jako przykład substancji możemy obrać sól kuchenną (chlorek sodu). Wiemy, że sól kuchenna może występować w różnych postaciach; jako sól stołowa w drobnych kryształach, sól w postaci większych kryształów oraz jako naturalne kryształy soli kamiennej, o wymiarach kilku lub kilkunastu centymetrów. Mimo wyraźnych różnic wszystkie te próbki soli mają te same zasadnicze właściwości, tj. słony smak, jednakową gęstość, taką samą temperaturę topnienia.
Ten przykład pokazuje, że cechy które opisują właściwości fizyczne w tych samych warunkach zewnętrznych są takie same dla wszystkie próbek określonej substancji, niezależnie od miejsca pochodzenia.
Właściwość chemiczna
Właściwości chemiczne określają zdolność substancji do przekształcania się w inną substancję
Na przykład węgiel w piecach przekształca się w produkt gazowy, gdy spala się przy dostępie powietrza. To charakterystyczne zachowanie się węgla stanowi właściwość chemiczną.
Innym przykładem właściwości chemicznej może być proces rdzewienia żelaza a właściwością chemiczną w tym procesie jest zdolność łączenia się żelaza z tlenem w wilgotnym powietrzu. Wynikiem tej przemiany jest rdza, która z punktu widzenia człowieka jest zjawiskiem szkodliwym.
Innymi przykładami przemian chemicznych są;
- palenie się gazu ziemnego
- trawienie pożywienia w żołądku
- łączenie się tlenu z hemoglobiną znajdującą sie we krwi
- rozkład proszku do pieczenia podczas wypieku ciast
- i wiele innych.
Substancją jest jednorodny materiał o określonym składzie chemicznym
Przemiana fizyczna to taka przemiana, podczas której nie ulega zmianie rodzaj substancji. Zmieniają się natomiast tylko jej właściwości fizyczne takie jak gęstość, stan skupienia, stan rozdrobnienia, barwa, twardość, kowalność, ciągliwość, temperatura topnienia, temperatura wrzenia, przewodnictwo cieplne. Przykładem przemiany fizycznej jest:
Zamarzanie wody
Po naciśnięciu przycisku dzwonka elektrycznego możemy usłyszeć dźwięk
Naciskając włącznik prądu dostrzegamy rozżarzenie się druciku żarówki.
Przy zmianach temperatury można obserwować zmiany wysokości słupka rtęci w termometrze
Gdy ogrzewamy wodę w czajniku zdarza się, że pokrywka podnosi się , wypychana ciśnieniem pary.
Natomiast przemiana chemiczna to taka przemiana, podczas której powstają nowe substancje o odmiennych właściwościach fizycznych i chemicznych. Przykładem przemiany chemicznej jest: Spalanie papieru, Pieczenie ciasta, Oddychanie.
Niekonserwowane elementy metalowe karoserii samochodów, narzędzia, konstrukcje
stalowe pokrywają się nalotem i zmieniają się w brunatną łuszczącą się substancję – rdzę.
Kiszenie ogórków, Na miedzianych dachach budowli powstaje zielona patyna
Na srebrnych sztućcach stołowych i biżuterii – czarna trudna do usunięcia powłoka.
Proces fotosyntezy 6CO2+ 6H2O->C6H12O6 + 6O2
|
| Dzisiaj stronę odwiedziło już 1 odwiedzający (1 wejścia) tutaj!
|
|
|
|